 國內熱線
國內熱線
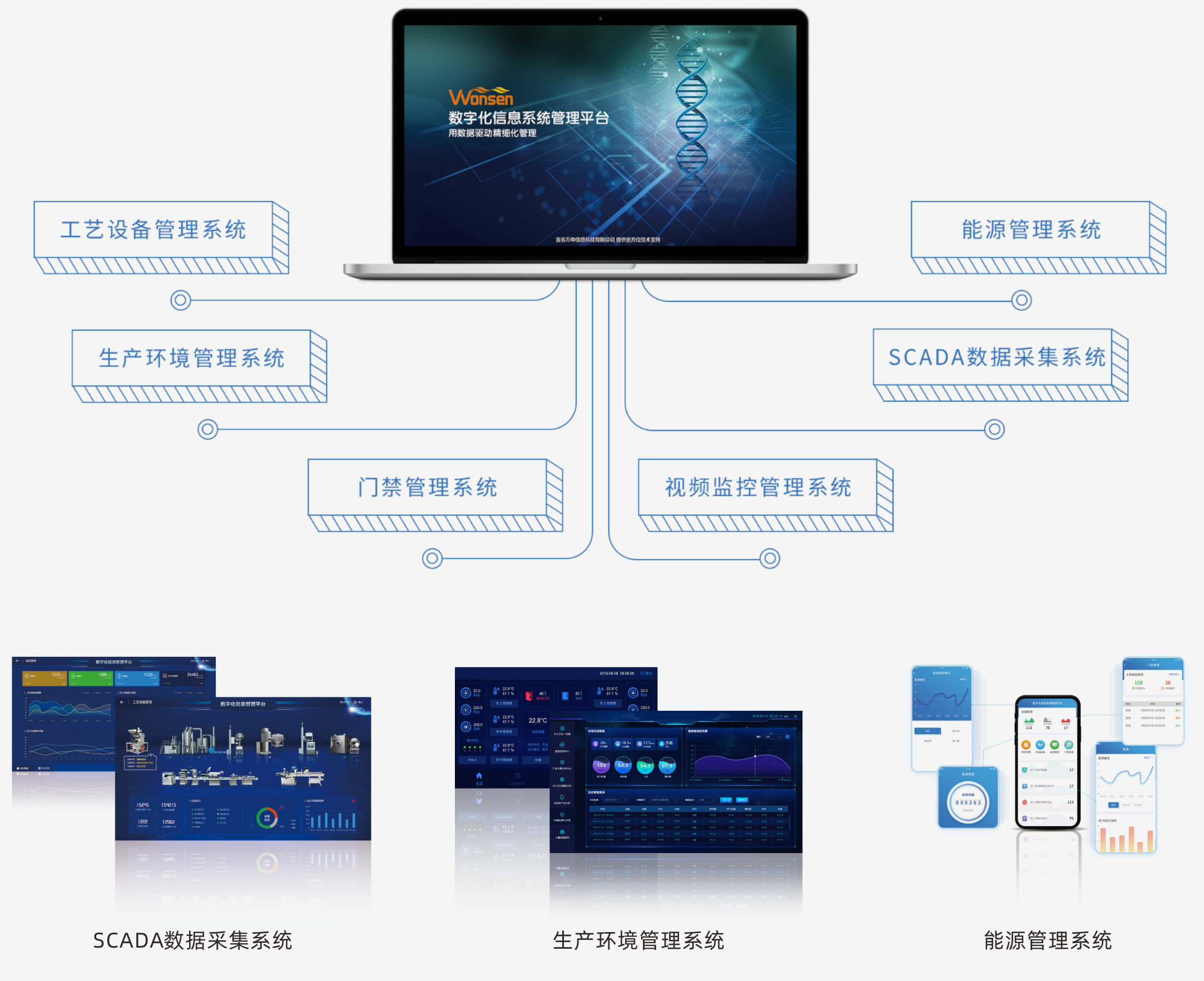
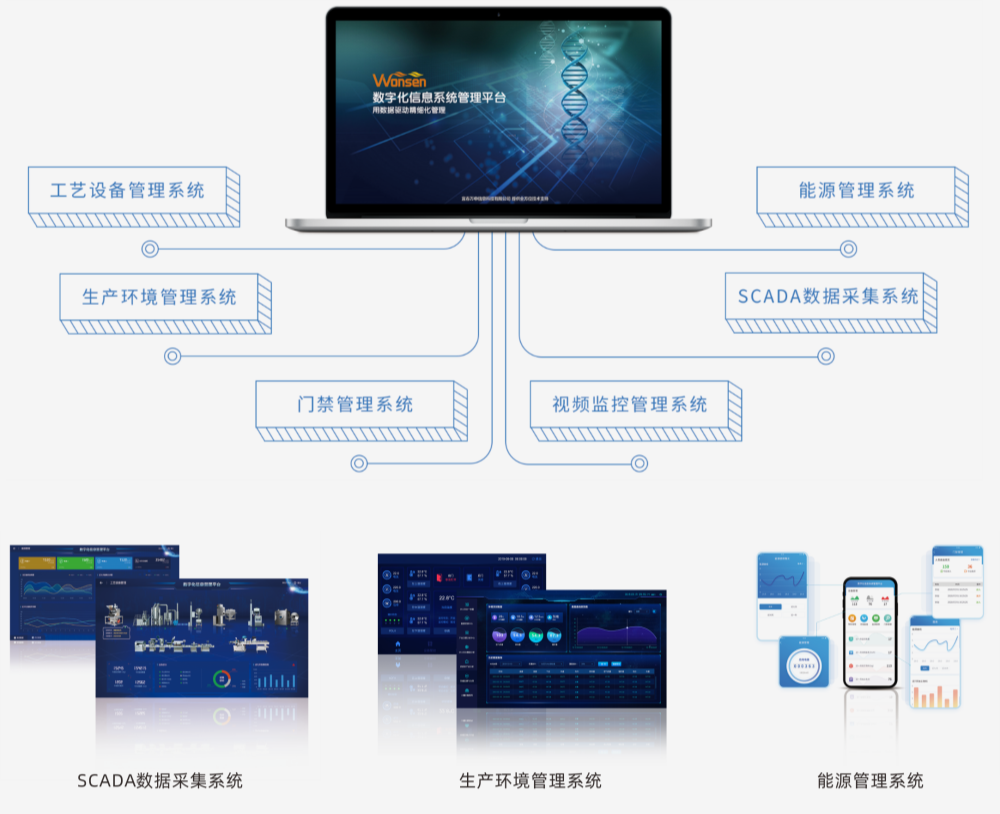
數字化信息平臺
數字化信息管理平臺把各工藝設備和公用系統進行集成,將設備運行數據、生產數 據、能源數據、環境數據等統一采集到實時數據庫中,通過數據進行分析、處理、 優化,使得整個生產過程可視化、數據化并形成集中的電子批記錄,實現企業信息 化、數字化、智能化管理。
數據采集
通過網關和工業互聯網平臺,實現數據實時采集與匯聚,為生產監控與生產執行提供數據基礎。
生產監控
實時了解加工現場信息,對生產決策作出快速響應。
電子記錄
保證記錄的真實性、準確性和一致性,能夠對修改進行跟蹤與查詢。
數據報表
提供個性化定制報表,提高企業管理效率。
接入第三方平臺
能接入原有erp、mes、pdm、lims等系統,避免信息孤島。
Pc、App、大屏可視化
通過多種平臺為不同管理者提供所需信息,滿足客制化需求。

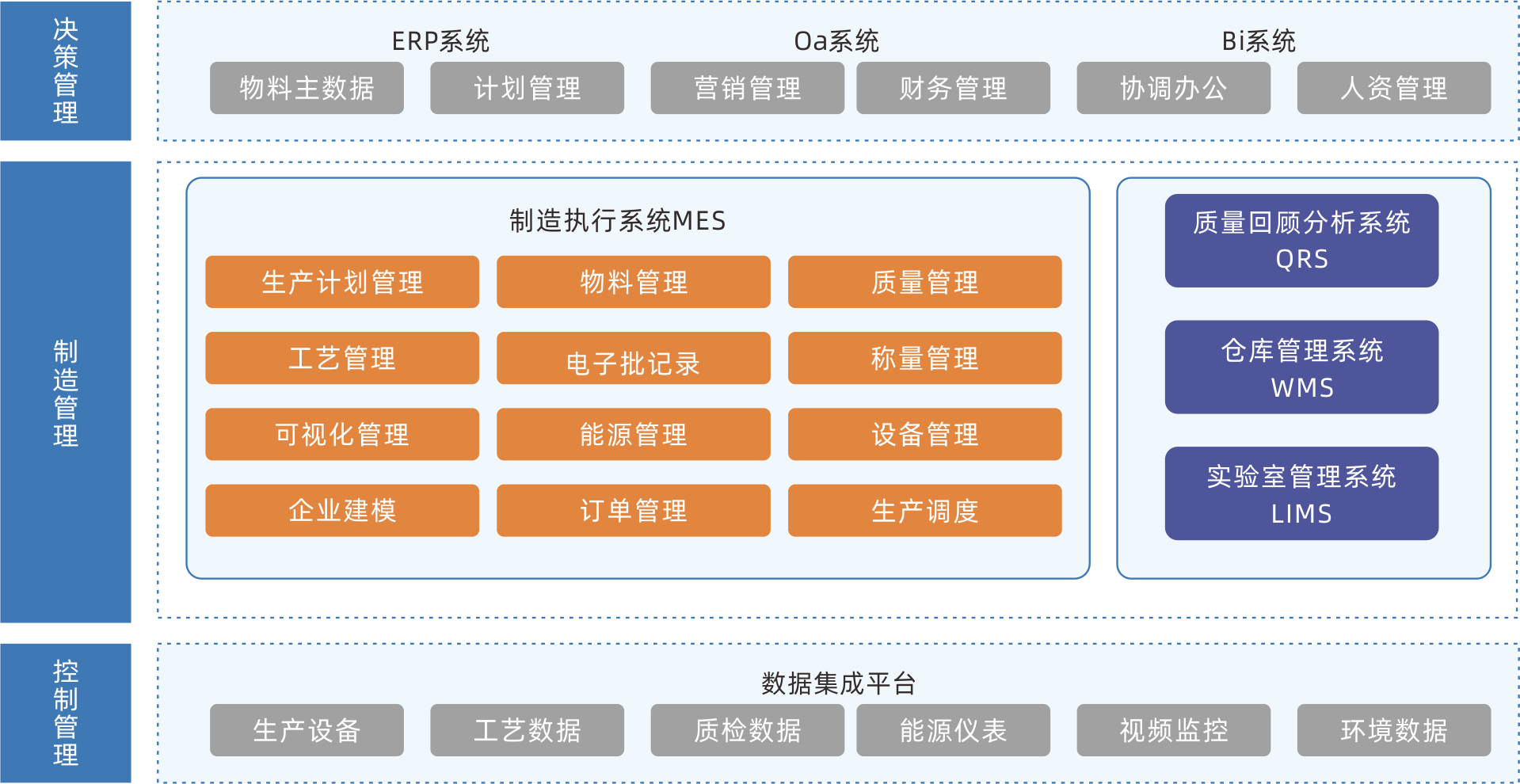
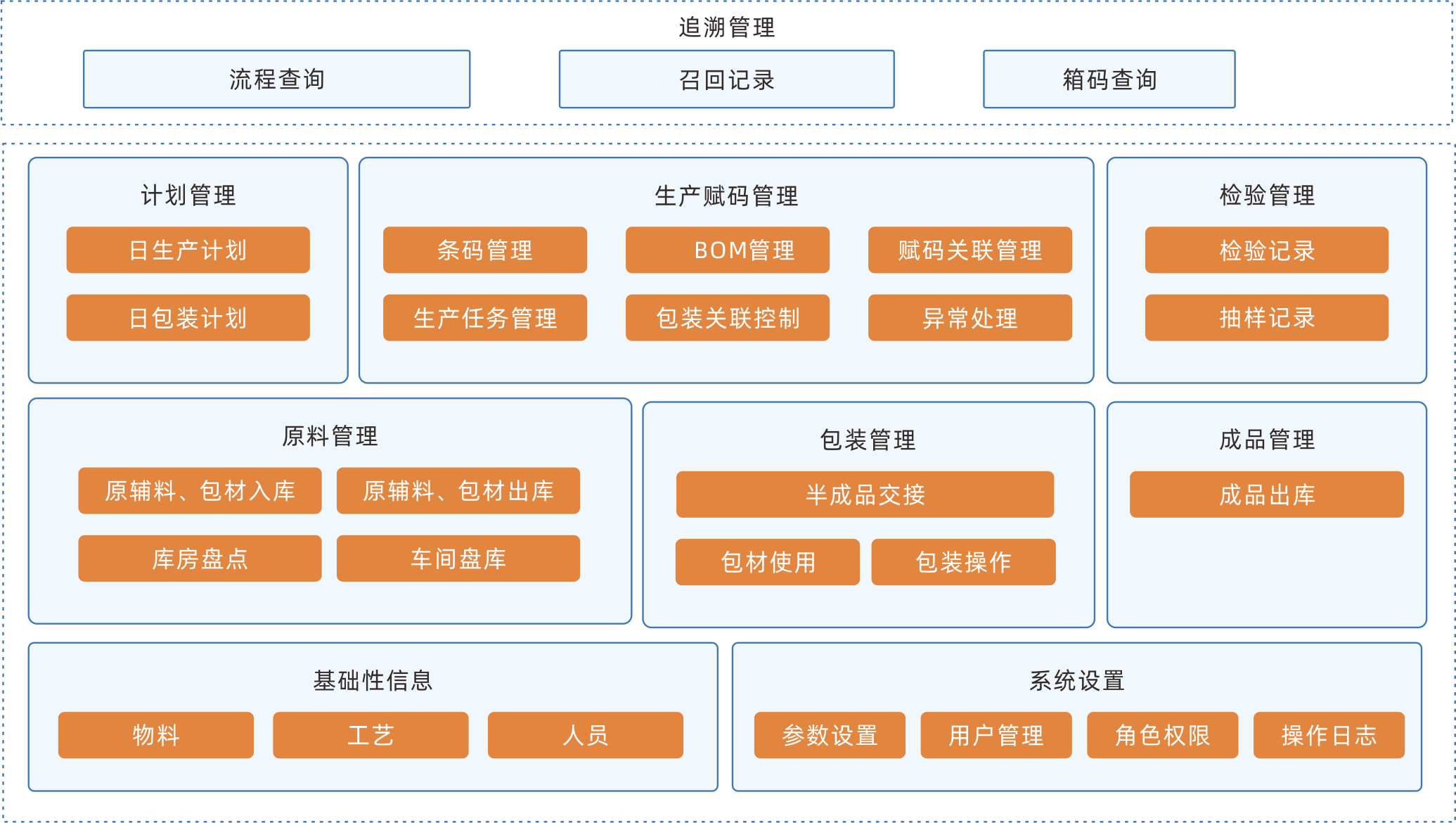
MES制造執行系統
MES是面向制造全過程執行層的生產信息管理系統,把企業資源管理與車間作業現場控制連接起來,將真正成為企業的生產指揮中心、生產協作平臺。系統涵蓋物料管理、配方管理、計劃排程管理、生產調度管理、庫存管理、質量管理、成本管理,數據分析分解等管理模塊,為企業打造一個扎實、可靠、可行的制造協同管理平臺。
持續優化生產過程,降低生產成本,縮短交貨周期,提高產能
對生產線、工藝、生產物料、產能等信息進行信息化管理,幫助企業實現精益化生產制造的目標。
有效防止信息失真
采用透明化的生產監控技術,使得生產過程全程可控,促進生產計劃的調整,防止信息失真,保證生產信息的即時性與準確性。
為智能排產提供基礎數據支持
能夠實時掌握生產過程中的所有信息,為后續升級的智能化排產做準備。
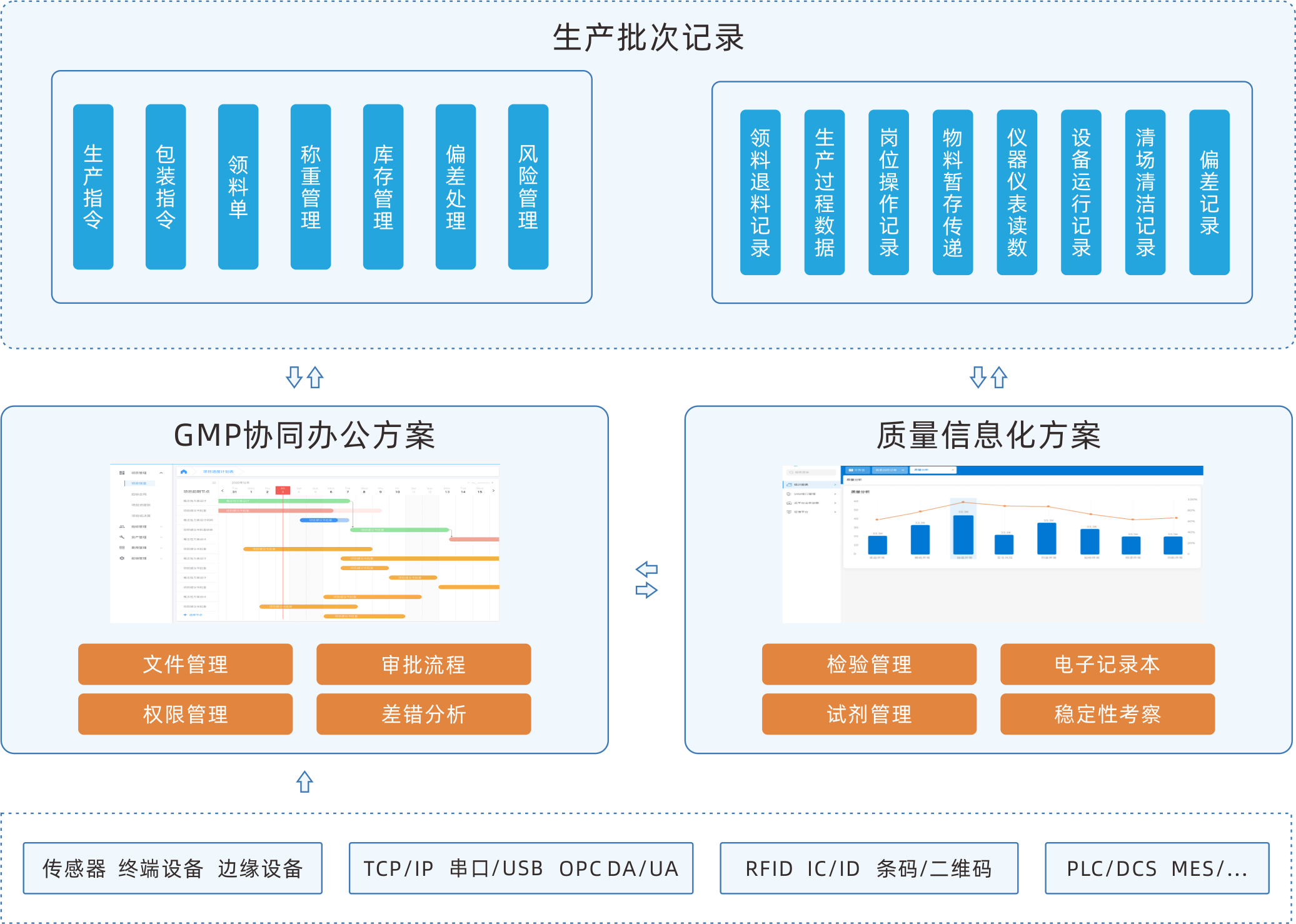
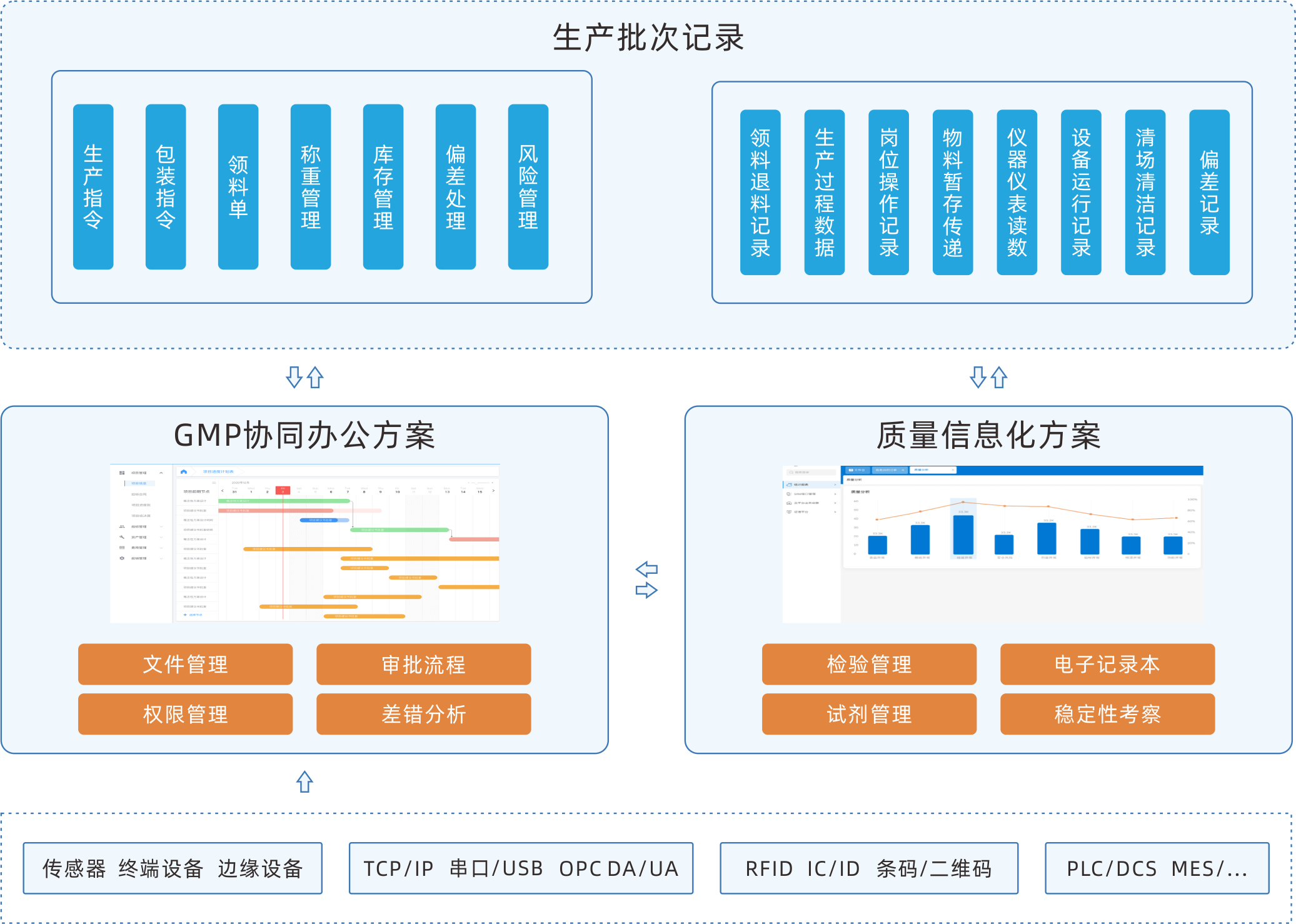
EBR電子批記錄系統
EBR軟件可按照生產的標準操作流程執行電子程序,將設備、環境等的實時數據作 為更加全面的補充增加進批記錄中,將藥品生產全過程中涉及到的各環節數據進行 采集、匯總、分類、整理,將批生產記錄、批包裝記錄、批檢驗記錄整合成為真 實、完整、準確、安全、高效的記錄,可實現生產車間內的無紙化生產。
協同整合的系統
除了單獨部署之外,可以作為一個完整MES的單獨模塊,與其他模塊和第三方系統進行數據交互。
高效的操作流程
自動顯示每臺設備所需的所有文件和圖紙的批準版本,以及每道工序的操作SOP。自動記錄已經完成提作的用戶,并提供電子簽名,以加速簽名流程。
設備數據采集
自動采集PLC/SCADA系統數據,將它們自動錄入批記錄,節省寶貴時間,確保100%的準確性。
自動工作流
預設的工作流程,保證電子批記錄放行工作的有序開展,消息提醒和自動審批推送。
實時跟蹤與異常報警
實時監控電子批記錄數據的采集和填寫情況,通過設定標準的工藝參數與采集或者填寫的參數進行實時校驗。數據異常時,可以按照設定的規則,自動生成異常信息,生產和質量人員可以實時對異常進行偏差分析與評估。
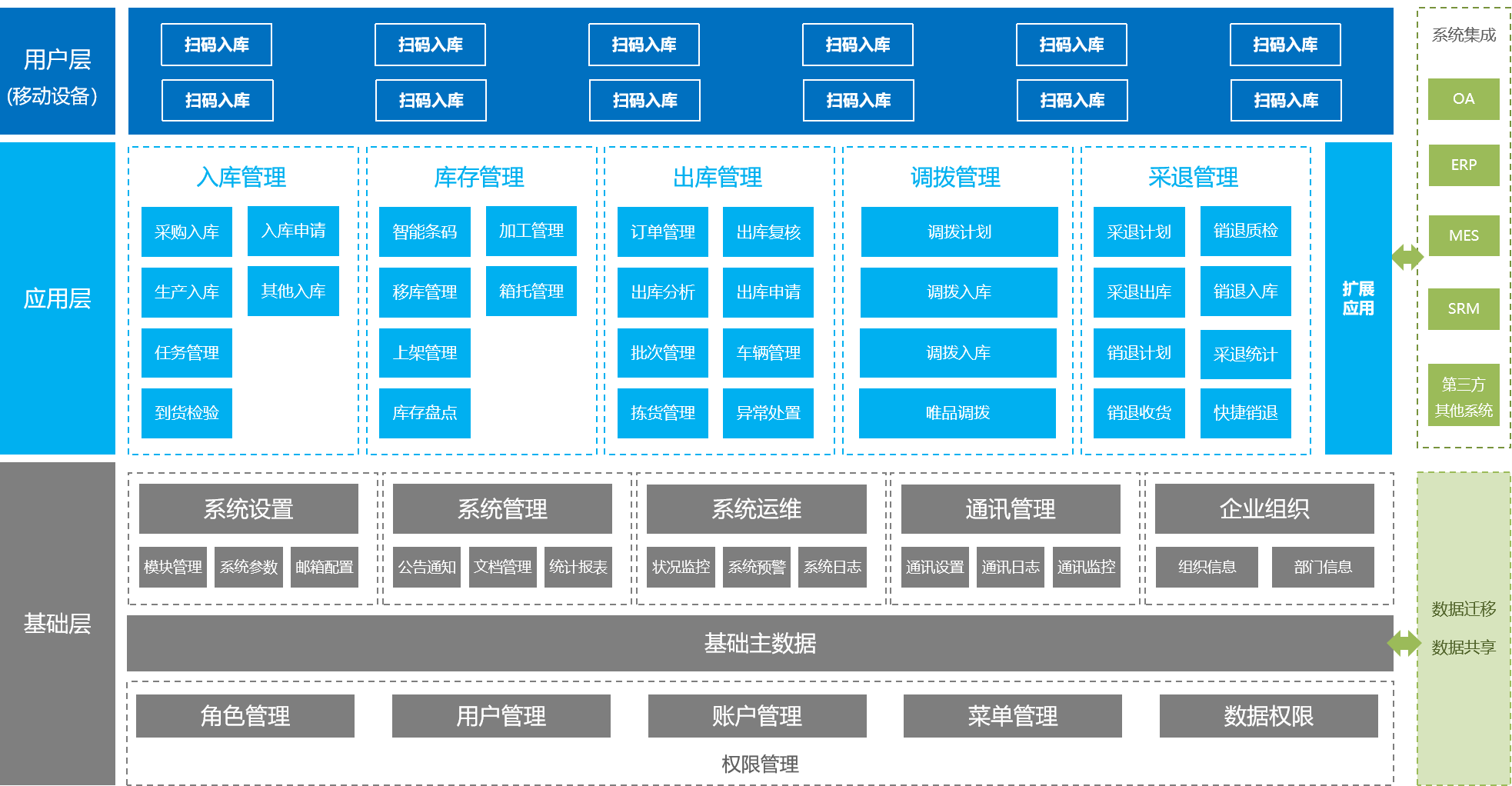
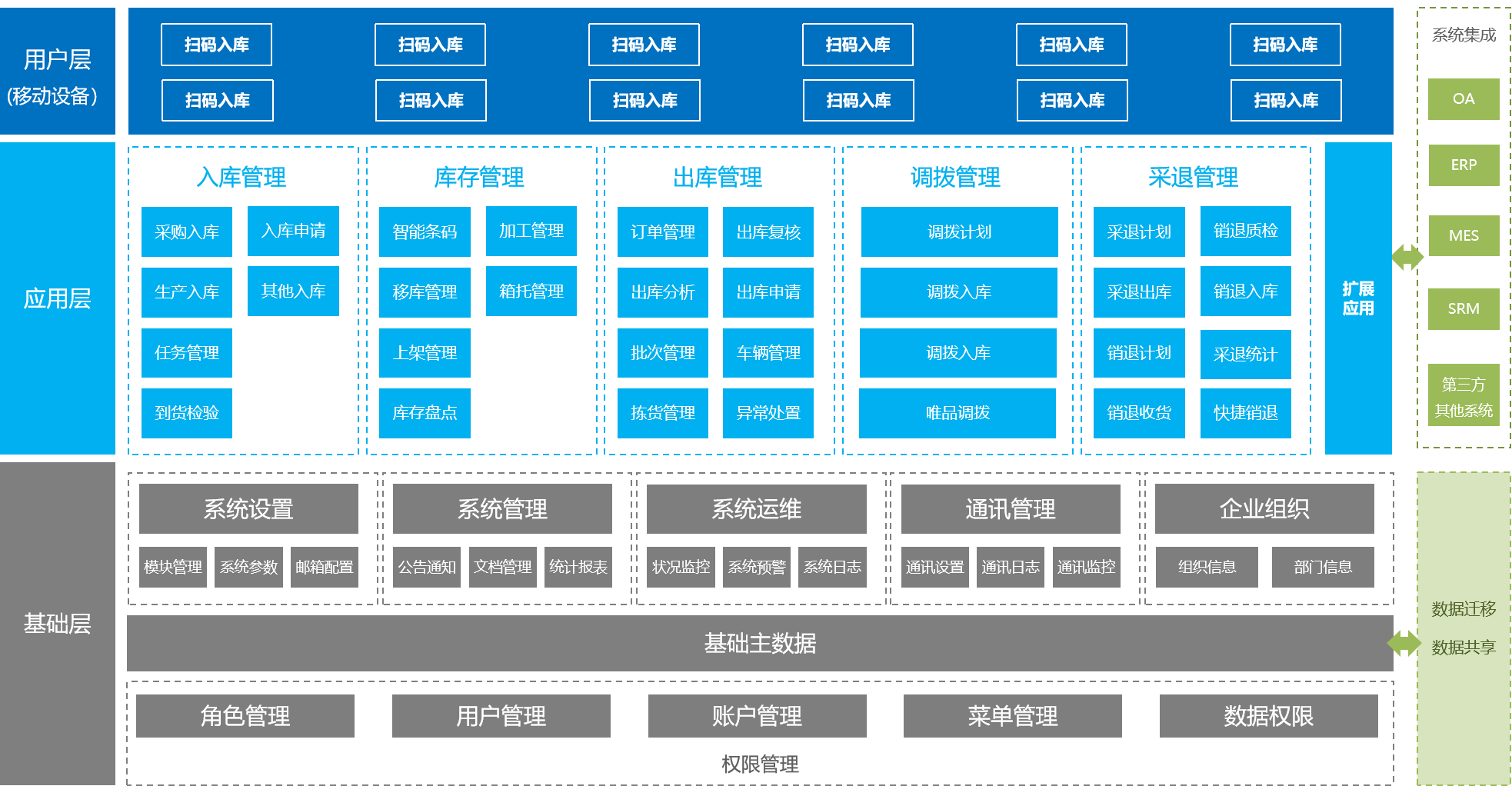
WMS倉儲管理系統
WMS倉儲管理系統是對倉庫更精細化管理的系統,有效控制并跟蹤倉庫業務的物流和成本管理全過程,實現完善的企業倉儲信息管理。
提高庫存空間利用率
通過各環節實時數據采集、分析,幫助管理者做出科學決斷,提高倉庫管理水平,提高庫存準確率,降低庫存成本。
有效防止信息失真
優化作業路徑,指導作業方法,合理降低物流作業成本。
為智能排產提供基礎數據支持
利用移動端的便捷處理、智能化信息技術,降低對倉庫員工經驗能力的要求,有效隱低勞動力成本。

信息追溯系統
追溯系統對產品的原料、生產過程、流通等環節全部進行掃碼標記,建立追溯體系,從而實現產品追溯管理,以便對各個環節的風險進行管控。
追溯一站式服務
實現原料進廠、產品生產、倉儲物流、終端銷告、市場消費的全程可視化管理,協助企業快速建立滿足國家與市場監管的追溯系統。
供應鏈全程管控
完善企業供應鏈各環節的計劃、協調、操作、控制、優化的活動與過程,獲得對整個供應鏈網絡的實時觀察。
數據一站式協同
消除信息孤島,企業數據與全產業鏈上下游數據可互通互聯、實時共享、高效協同。
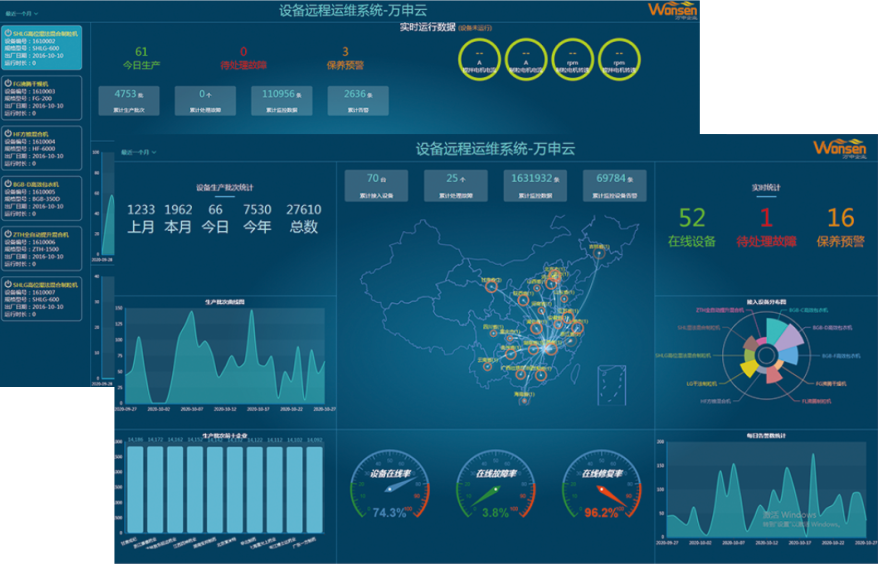
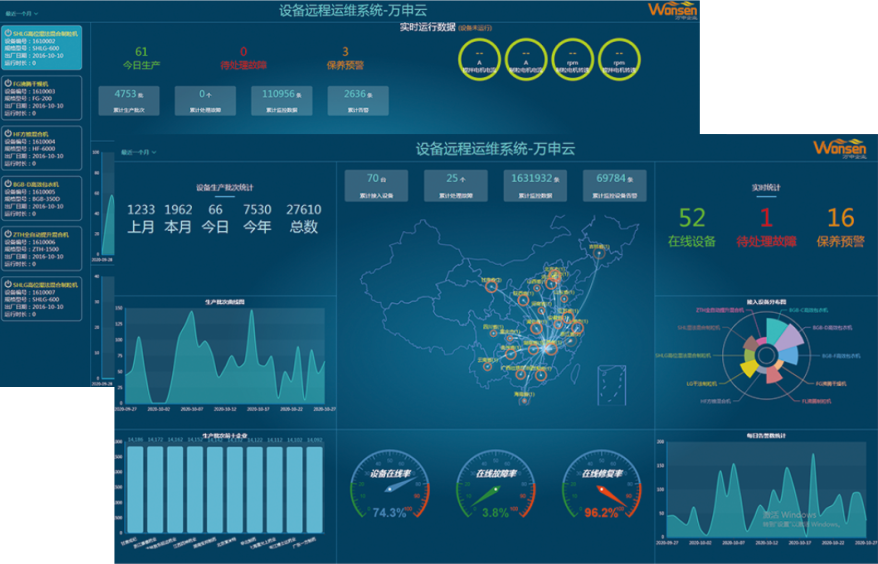
遠程運維系統
設備遠程維保系統是以數據應用云+智能網關為基礎的遠程綜合管理系統。智能網關與設備端相連自動采集運行狀態和相關數據(地理位置、溫濕度、壓力、轉速、流量等),并將信息發送到數據應用云平臺。幫助企業實現設備管理、監控、預警、診斷、維護工單管理,為客戶提供設備的全生命周期的服務,實現企業資產效益的全面提升。
設備維保
計劃制定周期任務生成、完成率統計,全程智能。
設備報修
可以通過平臺查看設備的報警和健康狀態,同時具備自動報警提醒的功能。
備品備件
庫存查詢、庫存預警、消耗統計、用量分析。
設備維保
計劃制定周期任務生成、完成率統計,全程智能。
設備報修
可以通過平臺查看設備的報警和健康狀態,同時具備自動報警提醒的功能。
備品備件
庫存查詢、庫存預警、消耗統計、用量分析。

計算機化系統驗證
計算機化系統驗證是制藥及相關行業質量保證中的重要部分,我們“遵從GXP計算,確保系統的實施和應用符合法規的一致性、數據機化系統監管的風險管理方法”完整性要求。
參考法規與指南
FDA21CFR Partll美國聯邦法規21篇第11部分電子記錄與電子簽名。
FDA聯邦法規第21篇第210211部分,成品藥的現行生產質量管理規范。
歐盟藥事法規第4卷GMP,附錄11計算機化系統。
2010年修改版GMP,附錄1 計算機化系統,附錄2 確認與驗證。




































 視頻號
視頻號
 微信公眾號
微信公眾號





